ГЛЮКУРОНОВАЯ КИСЛОТА одноосновная гексуроновая к-та, образующаяся из D-глюкозы...


К азотистым соединениям относятся белки, пептиды, аминокислоты и их производные, нуклеиновые кислоты, нуклеотиды и их производные, а также азотистые производные сахаров. Основная часть связанного азота приходится на белки, поэтому азотистый обмен часто отождествляют с белковым. Хотя аминокислоты, образующиеся при распаде белков, могут быть повторно использованы для биосинтеза белка (в среднем 5 раз), для нормальной жизнедеятельности необходимо постоянное поступление аминокислот в составе пищи. Последствия недостаточного потребления белковых продуктов иллюстрируются квашиоркором - заболеванием детей вследствие алиментарной недостаточности белка при нормальном покрытии потребностей в углеводах и липидах (рис. 8-1).
Рис. 8-1. Порочный круг при квашиоркоре
Принято считать, что минимальная суточная потребность взрослого человека в белке составляет около 100 г. Эта потребность возрастает при интенсивном росте, восстановлении после перенесенной болезни, беременности, лактации. Азотистый баланс (т.е. отношение потребленного азота к экскретируемому) служит важным показателем состояния организма и, в частности, ростовых процессов.
Срок жизни белков в организме варьирует в диапазоне от десятков минут до нескольких месяцев, в среднем составляя 3 нед. Этот срок может снижаться факторами, стимулирующими катаболизм, например глюкокортикоидами или провоспалительными цитокинами.
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Пепсин желудка. Основная протеиназа желудка пепсин (семейство аспартатных протеиназ, по наличию в активном центре двух остатков аспарагиновой кислоты) образуется под действием кислой среды полости желудка из двух предшественников - пепсиногенов I и II (или A и C), секретируемых главными клетками желудка. Поступление пищи стимулирует высвобождение пепсиногенов из секреторных гранул с параллельным усилением синтеза de novo. Стимулирующее действие на секрецию пепсиногенов разнообразных нервных и гуморальных факторов реализуется преимущественно посредством повышения уровня цАМФ (секретин, вазоактивный интестинальный пептид (ВИП), катехоламины) или внутриклеточного Ca 2+ (холецистокинин - ХЦК, гастрин, гастрин-рилизинг пептид - ГРП, бомбезин, ацетилхолин). Соматостатин подавляет секрецию. Известное ульцерогенное действие фармакологических доз глюкокортикоидов может быть отчасти связано с их стимулирующим действием на экспрессию гена пепсиногена C, в регуляторной области которого обнаружен функциональный ГКЧЭ. Базальный уровень глюкокортикоидов необходим для нормального уровня экспрессии пепсиногенов.
Панкреатические протеиназы. Поступающие из желудка в кишечник пептидные продукты переваривания пепсином подвергаются дальнейшему гидролизу несколькими протеиназами, образующимися в просвете двенадцатиперстной кишки из неактивных предшественников (зимогенов), поступающих из поджелудочной железы. Каскад активации инициируется энтеропептидазой (или энтерокиназой), экспрессируемой в энтероцитах и бокаловидных клетках двенадцатиперстной кишки. Этот фермент удаляет из полипептидов трипсиногена (3 изоформы) ингибирующие фрагменты. Образующийся трипсин (семейство сериновых протеиназ) катализирует далее аутоактивацию и активацию химотрипсиногена (семейство сериновых протеиназ) и прокарбоксипептидазы (2 изоформы). Синтез и секреция зимогенов в поджелудочной железе адаптивно стимулируются белковой пищей, предположи-
тельно с участием холецистокинина. Показано также стимулирующее действие ацетилхолина, инсулина, секретина, бомбезина на секрецию зимогенов. Полагают, что одной из причин развития панкреатита может служить внутриклеточная (т.е. преждевременная) активация зимогенов.
ТРАНСПОРТ ОЛИГОПЕПТИДОВ И АМИНОКИСЛОТ
Олигопептиды. Основная часть продуктов переваривания белков в желудке и кишечнике представлена ди- и трипептидами. Данные олигопептиды всасываются клетками слизистой оболочки тонкой кишки, где под действием пептидаз гидролизуются до аминокислот. Транспорт олигопептидов через апикальную мембрану клеток кишечника является энергозависимым и определяется Н+-пептид- ным котранспортером, PepT1.
Этот транспортер представляет собой гликозилированный белок, содержащий 12 трансмембранных доменов. Отличается низкой субстратной специфичностью (способен транспортировать 400 различных дипептидов, 8000 трипептидов, ряд лекарственных препаратов, имитирующих структуру ди- и трипептидов, например, β-лактамовые антибиотики) и низким сродством к субстратам. Энергия для транспорта обеспечивается работой Na + ,K + -АТФазы, локализованной на базолатеральной поверхности клеток. Снижение концентрации Na+ в клетках служит движущей силой для функционирования локализованного на апикальной поверхности клеток Na + /Н + -обменника, выводящего протоны из клеток в просвет кишечника. Эти протоны затем возвращаются в клетки вместе с олигопептидами через Н + -пептидный котранспортер PepT1 (рис. 8-2).
Активность Н + -пептидного котранспортера PepT1 регулируется субстратами на транскрипционном уровне, однако данные о направленности этой регуляции противоречивы. Хотя стимулирующий эффект дипептидов на уровень PepT1 может быть воспроизведен in vitro на культуре клеток кишечника, не исключено, что in vivo действие субстрата может быть опосредовано его стимулирующим действием на гормоны желудочно-кишечного тракта, такие, как глюкагоноподобный пептид. Инсулин стимулирует активность PepT1, но это происходит на посттрансляционном уровне, за счет повышения встраивания PepT1 в плазматическую мембрану. Лептин, который может поступать к клеткам кишечника как через системный кровоток, так и через просвет
 Рис. 8-2.
Транспорт олигопептидов в клетки слизистой кишечника
Рис. 8-2.
Транспорт олигопептидов в клетки слизистой кишечника
кишечника после его секреции желудком, повышает экспрессию PepT1 на транскрипционном уровне, а тиреоидные гормоны снижают.
В почках, легких, мозгу и ряде других органов и тканей экспрессируется родственный PepT1 транспортер олигопептидов, PepT2. Принцип работы данного транспортера сходен с таковым PepT1.
В качестве субстратов PepT2 может использовать ди-, три- и тетрапептиды, предпочтительно дипептиды. Его сродство к субстратам существенно выше сродства PepT1. В почках PepT2 локализован на апикальной поверхности клеток почечных канальцев, где он обеспечивает реабсорбцию олигопептидов из мочи. Исключая ингибирующее действие тиреоидных гормонов и эпидермального фактора роста на экспрессию PepT2, гормональная регуляция этого транспортера практически не исследована.
Аминокислоты. Липидный бислой плазматической мембраны клеток непроницаем для аминокислот. Для всасывания аминокислот в кишечнике, реабсорбции из мочи, обратного захвата в синапсе, выхода в кровоток, поступления в клетки-потребители используется широкий спектр транспортеров аминокислот, которые делят на две основные группы: независимые и зависимые от Na + . Транспортеры аминокислот проявляют весьма высокую специфичность в отношении определенных групп субстратов.
Субстратами транспортеров аминокислот могут служить также биогенные амины, тиреоидные гормоны, ряд лекарственных препаратов. Значительная часть зависимых от Na+ транспортеров осуществляет энергозависимый перенос аминокислот через плазматическую мембрану, тогда как независимые от Na + транспортеры обеспечивают облегченную диффузию субстратов. Примером транспортеров первой группы может служить сопряженный с протонами транспортер аминокислот, PAT1, экспрессируемый преимущественно на апикальной поверхности клеток слизистой кишечника. Принцип работы данного транспортера сходен с таковым для транспортера олигопептидов PepT1, описанного выше. Регуляция активности PAT1 может осуществляться, в частности, путем фосфорилирования Na + /H + -обменника или регулирующих его белков. Транспортер SN1 переносит аминокислоту также за счет обмена Na+/ H+, но этот обмен осуществляется самим транспортером и происходит в направлении, обратном описанному для транспортера PAT1, сопряженного с Na + /H + -обменником (рис. 8-3). Транспортер SN1, в частности, обеспечивает поступление глутамина в перипортальные гепатоциты для синтеза мочевины и, напротив, экспорт глутамина перицентральными гепатоцитами в кровоток и далее в почки. В проксимальных канальцах почек экспрессия данного транспортера адаптивно возрастает при хроническом ацидозе (функция - аммонийгенез для выведения протонов, см. ниже), и этому росту способствуют глюкокортикоиды. Еще один вариант зависимого от Na + транспорта аминокислот можно наблюдать в случае транспортера ATA1, осуществляющего совместный транспорт аминокислоты и Na + . В данном случае протоны выступают в качестве аллостерических регуляторов транспортера (см. рис. 8-3).
Примером системы транспорта аминокислот путем облегченной диффузии служит система L. Транспортеры данной группы построены из двух субъединиц: легкой и тяжелой, связанных дисульфидной связью. Легкая субъединица, например LAT1, 12 раз пронизывает плазматическую мембрану. Тяжелая гликозилированная субъединица, например 4F2hc, содержит лишь один трансмембранный домен (рис. 8-4). Данная группа транспортеров обеспечивает преимущественно взаимообмен между аминокислотами, локализованными в клетке и во внеклеточной среде. Значение данной системы транспорта, повидимому, заключается в обеспечении трансмембранного перемещения аминокислот, являющихся плохими субстратами для зависимых от Na + транспортеров. Так, локализованный на апикальной поверхности клеток проксимальных канальцев почек димерный транспортер rbAT/
 Рис. 8-3.
Варианты зависимых от Na+ транспортеров аминокислот (а.к.): a -
транспортер
SN1 осуществляет совместный транспорт Na+ и аминокислоты в обмен на
протон (протон необходим для переориентации SN1 в мембране). SN1
обеспечивает импорт глутамина в перипортальные гепатоциты из кровотока и
экспорт синтезированного глутамина из перицентральных гепатоцитов;
Рис. 8-3.
Варианты зависимых от Na+ транспортеров аминокислот (а.к.): a -
транспортер
SN1 осуществляет совместный транспорт Na+ и аминокислоты в обмен на
протон (протон необходим для переориентации SN1 в мембране). SN1
обеспечивает импорт глутамина в перипортальные гепатоциты из кровотока и
экспорт синтезированного глутамина из перицентральных гепатоцитов;
б - электрогенный транспортер ATA1 действует сходно с SN1, но не переносит протон
 Рис. 8-4.
Транспортеры аминокислот:
Рис. 8-4.
Транспортеры аминокислот:
а - димерный транспортер аминокислот b 0,+ построен из тяжелой цепи rbAT (светлый тон) и легкой цепи b 0,+ +AT (темный тон), связанных дисульфидной связью. Локализован на апикальной поверхности клеток почек, тонкого кишечника, мозга;
б - транспортер b 0,+ осуществляет независимый от Na + обмен нейтральных и двухосновных аминокислот и совместно с родственным транспортером LAT2-4F2hc в кооперации с зависимыми от Na+ транспортерами обеспечивает реабсорбцию цистина, аргинина, лизина, орнитина. Недостаточность транспортера сопровождается цистинурией
b 0,.+ AT обеспечивает реабсорбцию из первичной мочи цистина, который далее в клетках превращается в цистеин, секретируемый затем в кровь через базолатеральную мембрану клетки посредством второго димерного транспортера - 4F2/LAT2. Энергетически работа данной системы реабсорбции обеспечивается зависимым от Na+ транспортом аминокислот, обмениваемых на цистин и цистеин соответственно. Показано стимулирующее действие глюкокортикоидов на экспрессию транспортеров этого типа в почках.
ОБМЕН АМИНОКИСЛОТ
Аминокислоты представляют собой, с одной стороны, строительный материал для биосинтеза белков и других содержащих азот соединений, а с другой - источник энергии. В зависимости от того, способна ли та или иная аминокислота синтезироваться в организме, различают заменимые и незаменимые аминокислоты.
Для биосинтеза белка необходимым условием является поддержание в клетке баланса между аминокислотами, соответствующего их содержанию в белках. Этот баланс в значительной мере поддерживается за счет взаимопревращений аминокислот. Взаимопревращения включают реакции двух типов: переаминирования и окислительного дезаминирования/восстановительного аминирования. Эти же реакции используются для деградации аминокислот при глюконеогенезе.
Обратимые реакции переаминирования, т.е. переноса аминогруппы с одного субстрата на другой, катализируются аминотрансферазами. Одним субстратом служит аминокислота X, по наименованию которой называют соответствующую аминотрансферазу, или соответствующая α-кетокислота X". Второй субстрат представлен парой α-кетоглутарат/глутамат. В зависимости от соотношения концентраций субстратов реакция будет направлена на образование либо аминокислоты X, либо глутамата. При накоплении глутамата последний может стать донором аминогруппы для α-кетокислоты Y" с образованием аминокислоты Y в реакции, катализируемой соответствующей аминотрансферазой. Аналогичным образом может быть достигнут паритет между другими аминокислотами.
Избыток аминокислот может быть ликвидирован путем окислительного дезаминирования глутамата под действием глутаматдегидрогеназы. Обратная реакция восстановительного аминирования, напротив, способна увеличить пул аминокислот в клетке
(рис. 8-5). Указанная на рисунке цепь реакций используется также в процессе глюконеогенеза: например, стимулируемая глюкокортикоидами при стрессе деградация мышечного белка сопровождается поступлением в кровь аланина, который в печени через пируват
 Рис. 8-5.
Взаимопревращения аминокислот.
Рис. 8-5.
Взаимопревращения аминокислот.
Аминотрансферазы переносят аминогруппу на α-кетоглутарат. Образовавшийся глутамат подвергается окислительному дезаминированию. Обратные реакции обеспечивают синтез аминокислот.
направляется на синтез глюкозы. Индуцируемому глюкокортикоидами глюконеогенезу способствует также известная способность этих гормонов стимулировать транскрипцию генов ряда аминотрансфераз.
ОБМЕН АММИАКА
Глутамин - важный источник энергии, особенно для клеток кишечника и иммунной системы, предшественник для глюконеогенеза, переносчик аммиака. Является преобладающей аминокислотой в крови. Обмен глутамина осуществляется с участием цитозольного фермента глутаминсинтазы и двух изозимов митохондриальной глутаминазы (рис. 8-6).
Активность печеночной глутаминазы возрастает при голодании, диабете и при высоком содержании белка в пище. Все эти состояния характеризуются повышенным катаболизмом поступающих в печень аминокислот, направленным отчасти на усиление глюконеогенеза и на удаление избытка азота через цикл мочевины. Повышение активности фермента происходит, в частности, под действием глюкагона за
 Рис. 8-6.
Взаимопревращения глутамата и глутамина
Рис. 8-6.
Взаимопревращения глутамата и глутамина
счет индукции транскрипции гена через цАМФ-чувствтвительный элемент (CRE) и глюкокортикоидов через ГКЧЭ (рис. 8-7).
При хроническом метаболическом ацидозе возрастает активность почечной глутаминазы. Основная задача этого фермента - генерация аммиака для связывания протонов и выведения их с мочой. Эффект реализуется на посттранскрипционном уровне за счет стабилизации мРНК фермента. Механизм включает взаимодействие pH-чувстви- тельного элемента (pHRE) З"-нетранслируемой области мРНК (представляющего собой прямой повтор из 8 оснований, обогащенный аденозином и уридином) с зета-кристаллином (см. рис. 8-7).
При стрессе возрастает активность глутаминсинтазы в мышцах, легких. Эффект реализуется на уровне транскрипции. Например, в легких мРНК фермента возрастает в 10 раз. Глюкокортикоиды действуют на экспрессию фермента через канонический ГКЧЭ в 1-м интроне и З полусайта ГКЧЭ в отдаленной регуляторной области гена.
При хроническом стрессе в почках возрастает активность глутаматдегидрогеназы, превращающей глутамат в α-кетоглутарат с высвобождением аммиака. Регуляция осуществляется на посттранскрипционном уровне путем стабилизации мРНК фермента за счет связывания расположенных в З"-нетранслируемой области четырех pHREs с зетакристаллином, т.е. аналогично регуляции почечной глутаминазы.
Утилизация образующегося при ацидозе в почках α-кетоглутарата происходит посредством индукции ферментов глюконеогенеза. Индукция одного из них - фосфоенолпируваткарбоксикиназы (PEPCK) происходит на транскрипционном уровне: снижение внут-
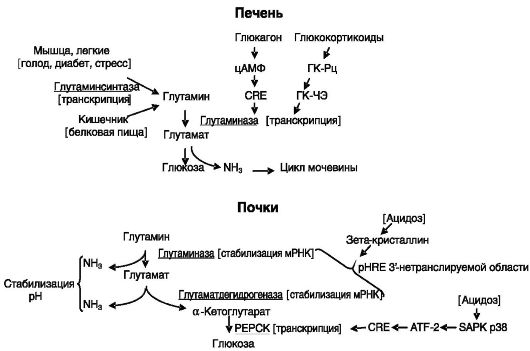 Рис. 8-7.
Регуляция обмена аммиака в печени и почках
Рис. 8-7.
Регуляция обмена аммиака в печени и почках
риклеточного pH сопровождается активацией активируемой стрессом протеинкиназы p38 (SAPK p38), которая фосфорилирует транскрипционный фактор ATF-2, взаимодействующий с цАМФ-чувствительным элементом (CRE) гена PEPCK, что стимулирует транскрипцию.
ЦИКЛ МОЧЕВИНЫ
Энергозависимое образование мочевины в печени у млекопитающих является основным путем утилизации аммиака, образующегося из аминокислот и других азотсодержащих соединений. Синтез мочевины включает образование из углекислого газа и аммиака карбамоилфосфата, который, взаимодействуя с орнитином, дает цитруллин. С участием аминогруппы аспартата через образование промежуточного соединения, аргининоянтарной кислоты, синтезируется аргинин, гидролиз которого дает мочевину и исходный орнитин (рис. 8-8).
Синтез карбамоилфосфата может катализироваться двумя ферментами: митохондриальной карбамоилфосфатсинтазой I, характерной для печени и отчасти кишечника, и широко экспрессируемым белком CAD (карбамоилфосфатсинтазой II), обладающим активностью кар-
 Рис. 8-8.
Цикл мочевины
Рис. 8-8.
Цикл мочевины
бамоилфосфатсинтазы, аспартаттранскарбамилазы и дигидрооротазы, который катализирует 3 из 6 реакций биосинтеза пиримидинов.
Перенос карбамоильной группы на орнитин катализируется орнитин-карбамоилтрансферазой. Митохондриальный фермент экспрессируется преимущественно в печени и слизистой кишечника. Недостаточность фермента является одной из причин гипераммониемии, сопровождающейся рвотой, летаргией, припадками и иногда смертью.
Недостаточность аргининосукцинатсинтазы, фермента, катализирующего взаимодействие цитруллина и аспартата, ведет к цитруллинемии, сопровождающейся приступами рвоты и задержкой умственного развития. Образование аргинина из аргининоянтарной кислоты катализируется аргининосукцинатлиазой. Недостаточность фермента служит причиной аргининсукциникэсидурии, сопровождающейся отставанием в умственном и физическом развитии, увеличением печени, повреждениями покровов, периодической потерей сознания.
Образование мочевины из аргинина катализируется аргиназой. Фермент представлен двумя изозимами (I и II). Цитозольная аргиназа I (гомотример) экспрессируется преимущественно в печени, где обеспечивает образование мочевины. Недостаточность печеночной аргиназы вызывает аргининемию, сопровождающуюся задержкой развития психомоторной функции, спастическим параличом четырех конечнос-
тей. Экспрессия аргиназы I, а также митохондриальной аргиназы II (гомогексамер) в других органах и тканях может обеспечивать другие стороны обмена азотистых соединений (обеспечение орнитина для биосинтеза глутамата, глутамина, ГАМК, агматина, полиаминов, креатина, пролина, NO). В частности, аргиназа может конкурировать с NO- синтазой за аргинин как субстрат и тем самым участвовать в регуляции процессов, управляемых NO и цГМФ (например, эрекции).
Ферменты цикла мочевины стимулируются катаболическими гормонами (глюкокортикоидами, глюкагоном) на транскрипционном уровне. Индукция может быть прямой или опосредованной через стимуляцию биосинтеза транскрипционного фактора C/EBP (рис. 8-9).
 Рис. 8-9.
Отдаленный
энхансер обеспечивает стимуляцию транскрипции гена
карбамоилфосфатсинтазы глюкокортикоидами и глюкагоном (а). Энхансер гена
аргиназы-1 обеспечивает стимуляцию глюкагоном и (опосредованно, через
индукцию C/EBP) глюкокортикоидами (б):
Рис. 8-9.
Отдаленный
энхансер обеспечивает стимуляцию транскрипции гена
карбамоилфосфатсинтазы глюкокортикоидами и глюкагоном (а). Энхансер гена
аргиназы-1 обеспечивает стимуляцию глюкагоном и (опосредованно, через
индукцию C/EBP) глюкокортикоидами (б):
С/ЕВР - белок, связывающий ССААТ/энхансер; HNF3 - ядерный фактор гепатоцитов 3; GRU - глюкокортикоидчувствительная единица
Adibi S.A. Regulation of expression of the intestinal oligopeptide transporter (Pept-1) in health and disease. Am J Physiol Gastrointest Liver Physiol. 2003;285(5):G779-788.
Curthoys N.P., Gstraunthaler G. Mechanism of increased renal gene expression during metabolic acidosis. Am J Physiol Renal Physiol. 2001;281(3):F381-390.
Desvergne B., Michalik L., Wahli W. Transcriptional regulation of metabolism. Physiol Rev. 2006;86(2):465-514.
Wagner C.A., Lang F., Broer S. Function and structure of heterodimeric amino acid transporters. Am J Physiol Cell Physiol. 2001;281(4):C1077-1093.
Wu G., Jaeger L.A., Bazer F.W., Rhoads J.M. Arginine deficiency in preterm infants: biochemical mechanisms and nutritional implications. J Nutr Biochem. 2004;15(8):442-451.
Казалось бы, такое вещество, как мочевая кислота, трудно сочетается с кровью. Вот в моче – другое дело, там ей место быть. Между тем, в организме постоянно идут различные обменные процессы с образованием солей, кислот, щелочей и других химических соединений, которые выводятся мочой и желудочно-кишечным трактом из организма, поступая туда из кровеносного русла.
Мочевая кислота (МК) тоже присутствует в крови, она образуется в небольших количествах из пуриновых оснований. Необходимые организму пуриновые основания, в основном, поступают извне, с пищевыми продуктами, и используются в синтезе нуклеиновых кислот, хотя в некоторых количествах вырабатываются организмом тоже. Что касается мочевой кислоты, то она является конечным продуктом пуринового обмена и сама по себе организму, в общем-то, не нужна. Ее повышенный уровень (гиперурикемия) указывает на нарушение пуринового обмена и может грозить отложением ненужных человеку солей в суставах и других тканях, вызывая не только неприятные ощущения, но и тяжелые болезни.
Норма мочевой кислоты в крови у мужчин не должна превышать 7,0 мг/дл (70,0 мг/л) или находится в пределах 0,24 – 0,50 ммоль/л. У женщин норма несколько ниже – до 5,7 мг/дл (57 мг/л) или 0,16 – 0,44 ммоль/л соответственно.
Образованная в ходе пуринового обмена МК должна раствориться в плазме, чтобы в дальнейшем уйти через почки, однако плазма не может растворить мочевой кислоты более чем 0,42 ммоль/л. С мочой из организма в норме удаляется 2,36 – 5,90 ммоль/сутки (250 – 750 мг/сут).
При своей высокой концентрации мочевая кислота образует соль (урат натрия), которая откладывается в тофусы (своеобразные узелки) в различных видах тканей, обладающих сродством к МК. Чаще всего тофусы можно наблюдать на ушных раковинах, кистях рук, стопах, но излюбленным местом являются поверхности суставов (локоть, голеностоп) и сухожильные влагалища. В редких случаях они способны сливаться и образовывать язвы, из которых в виде белой сухой массы выходят кристаллы уратов. Иногда ураты обнаруживаются в синовиальных сумках, вызывая воспаление, боль, ограничение подвижности (синовит). Соли мочевой кислоты можно найти в костях с развитием деструктивных изменений костных тканей.

Уровень мочевой кислоты в крови зависит от ее продукции в ходе пуринового обмена, клубочковой фильтрации и реабсорбции, а также канальцевой секреции. Чаще всего повышенная концентрация МК является следствием неправильного питания, особенно, это касается людей, имеющих наследственную патологию (аутосомно-доминантные или связанные с Х-хромосомой ферментопатии), при которой увеличивается выработка мочевой кислоты в организме или замедляется ее выведение. Генетически обусловленная гиперурикемия называется первичной , вторичная вытекает из ряда других патологических состояний или формируется под воздействием образа жизни.
Таким образом, можно сделать вывод, что причинами повышения мочевой кислоты в крови (излишняя продукция или замедленное выведение) являются:
Одной из причин повышения мочевой кислоты в крови медицина называет неправильное питание, а именно, потребление неразумного количества продуктов, аккумулирующих пуриновые вещества. Это – копчености (рыба и мясо), консервы (особенно – шпроты), печень говяжья и свиная, почки, жареные мясные блюда, грибочки и другие всякие вкусности. Большая любовь к этим продуктам приводит к тому, что нужные организму пуриновые основания усваиваются, а конечный продукт – мочевая кислота, оказывается лишней.

Следует отметить, что продукты животного происхождения, играющие не последнюю роль в возрастании концентрации мочевой кислоты, поскольку несут пуриновые основания, как правило, содержат большое количество холестерина . Увлекаясь такими любимыми блюдами, не соблюдая меры, человек может наносить двойной удар по своему организму .
Диета, обедненная пуринами, состоит из молочных продуктов, груш и яблок, огурцов (не маринованных, конечно), ягод, картофеля и других овощей в свежем виде. Консервация, жарка или всякое «колдовство» над полуфабрикатами заметно ухудшают качество пищи в этом плане (содержание пуринов в еде и накопление мочевой кислоты в организме).
Лишняя мочевая кислота разносится по организму, где выражение ее поведения может иметь несколько вариантов:

Все движения и превращения мочевой кислоты, обусловливающие ее поведение в целом, могут быть взаимосвязаны или существовать изолированно (как у кого пойдет).
Рассуждая о пуринах, мочевой кислоте, диете, никак не получается обойти вниманием такую неприятную болезнь, как подагра . В большинстве случаев ее связывают с МК, к тому же редкой ее назвать трудно.
Подагра преимущественно развивается у лиц мужского пола зрелого возраста, иной раз имеет семейный характер. Повышенный уровень мочевой кислоты (гиперурикемия) в наблюдается задолго до появления симптомов заболевания.
Первый приступ подагры тоже яркостью клинической картины не отличается, всего-то – заболел большой палец какой-нибудь ноги, а дней через пять человек опять чувствует себя вполне здоровым и забывает об этом досадном недоразумении. Следующая атака может проявиться через большой промежуток времени и протекает более выраженно:

Лечить болезнь непросто, а иногда и не безобидно для организма в целом. Терапия, направленная на проявление патологических изменений включает:
Эффективность лечения пациент может значительно повысить, если возьмется за диету, содержащую минимальное количество пуринов (только для нужд организма, а не для накопления).
Малокалорийная диета (лучше всего подходит стол №5, если у пациента все в порядке с весом), мясо и рыбка – без фанатизма, граммов 300 в недельку и не более. Это поможет больному снизить мочевую кислоту в крови, жить полноценной жизнью, не мучаясь приступами подагрического артрита. Пациентам с признаками этой болезни, имеющим лишний вес, рекомендуется использовать стол №8, не забывая разгружаться каждую неделю, но при этом помнить, что полное голодание запрещено. Отсутствие еды в самом начале диеты быстренько поднимет уровень МК и обострит процесс. А вот о дополнительном поступлении аскорбиновой кислоты и витаминов группы В следует подумать всерьез.

Все дни, пока будет длиться обострение заболевания, должны протекать без употребления мясных и рыбных блюд. Пища должна быть не твердой, впрочем, лучше вообще потреблять ее в жидком виде (молоко, фруктовые кисели и компоты, соки из фруктов и овощей, супы на овощном бульоне, каша-«размазня»). Кроме этого, пациент должен много пить (не меньше 2 литров в сутки).
Следует иметь в виду, что значительное количество пуриновых оснований имеется в таких деликатесах, как:

Напротив, минимальная концентрация пуринов отмечается в:

Это краткий список продуктов, которые запрещены или разрешены пациентам, обнаружившим первые признаки подагры и повышенную мочевую кислоту в анализе крови. Снизить мочевую кислоту в крови поможет вторая часть списка (молоко, овощи и фрукты).

Мочевая кислота в крови понижена, в первую очередь, при использовании противоподагрических средств, что абсолютно естественно, ведь они снижают синтез МК.
Кроме этого, причиной понижения уровня мочевой кислоты может стать уменьшение канальцевой реабсорбции, наследственно обусловленное снижение продукции МК и в редких случаях – гепатиты и анемия.
Между тем, пониженный уровень конечного продукта метаболизма пуринов (ровно, как и повышенный) в моче связан с более широким кругом патологических состояний, однако анализ мочи на содержание МК не такой уж и частый, он обычно интересует узких специалистов, занимающихся какой-то конкретной проблемой. Для самодиагностики пациентам он вряд ли может пригодиться.
Речь пойдет об особенностях метаболизма пуриновых оснований. Большинству людей это ни о чем не говорит. Но если вам знакомы слова «подагра», мочекаменная болезнь, инсулинорезистентность, сахарный диабет 2 типа, то знать суть о метаболизме пуринов необходимо. Казалось бы: а хирургия то здесь причем? А притом, что многие специалисты при болях в суставах и высокой мочевой кислоте ставят диагноз «подагра». На самом деле — все намного сложнее. К примеру подагрический артрит может быть при нормальных цифрах мочевой кислоты, и наоборот: высокая мочевая кислота может быть в ряде случаев у здорового человека.
Организм человека в основном состоит из четырех химических элементов, на долю которых приходится 89 % состава: С-углерод (50%), О-кислород(20%), Н-водород(10%) и N-азот (8,5%). Далее идет ряд макроэлементов: кальций, фосфор, калий, сера, натрий, хлор и др. Затем микроэлементы, количество которых очень мало, но они жизненно необходимы: марганец, железо, йод и пр.
Интересен нам будет четвертый в этом количественном списке — азот.
Живой организм — это динамическая система. По простому: вещества в него постоянно поступают (становясь частью организма) и выводятся из него. Основной источник азота для организма — белки. Поступающий с пищей белок в желудочно-кишечном тракте распадается до аминокислот, которые уже и включаются в обмен. Ну а каким образом азотсодержащие вещества выводятся из организма?
В процессе эволюции у животных выработались определенные особенности азотистого обмена.
Причем ключевым в определении этих особенностей будут: условия существования и доступ к воде.
Животных разделяют на три группы, имеющие различия в метаболизме азота:
Аммонио-литические
. Конечный продукт азотистого обмена — аммиак, NH3. Сюда относят большую часть водных беспозвоночных и рыб.
Все дело в том, что аммиак — токсичное вещество. И для его выведения нужно очень-очень много жидкости. Благо — он хорошо растворим в воде. С выходом на сушу в ходе эволюции возникла потребность в изменении метаболизма. Так появились:
Уреолитические . У этих животных появился так называемый «цикл мочевины». Аммиак связывается с СО2(углекислый газ). Образуется конечный продукт — мочевина. Мочевина не такое токсичное вещество и для ее выведения требуется заметно меньше жидкости. Кстати мы с вами относимся именно к этой группе. Мочевая кислота в процессе метаболизма в значительно меньших количествах также образуется, но распадается до малотоксичного и хорошо растворимого аллантоина. Но… Кроме человека и человекообразных обезьян. Это очень важно и к этому вернемся.
Урикотелические
. Предкам земноводных с уреолитическим обменом пришлось приспосабливаться к засушливым регионам. Это пресмыкающиеся и прямые предки динозавров — птицы. У них конечным продуктом является мочевая кислота. Она очень плохо растворяется в воде и для ее выведения из организма как раз воды много и не требуется. В помете у тех же птиц количество мочевой кислоты очень большое, фактически выводится в полутвердом виде Поэтому птичий помет («гуано») — основная причина коррозии и разрушения металлоконструкций мостов. Лакокрасочное покрытие автомобиля тоже портит — будьте внимательны, мойте сразу.
Это классическая гексагональная долька печени. В общем так печень выглядит под микроскопом. Похожа на Москву-сити, только вместо кремля — центральная вена. А интересовать нас будут «домики», плотно прилежащие друг к другу. Это гепатоциты — ключевые клетки печени.
Славянское слово печень произошло от слова «печь». Действительно, температура органа на градус выше температуры тела. Причина в этом — очень активный обмен веществ в гепатоцитах. Клетки действительно уникальные, в них протекает около 2 тысяч химических реакций.
Печень — это основной орган, который продуцирует мочевую кислоту. 95% выводимого азота — синтез мочевой кислоты как конечный продукт химических реакций в печени
. И только 5% — окисление пуриновых оснований, поступающих извне с пищей. Поэтому коррекция питания при гиперурикемии не является ключевым в лечении.
 Откуда берутся пурины?
Откуда берутся пурины?
1. Пурины, которые поступают с пищей
. Как уже отмечалось — это небольшое количество — около 5%. Те пурины, которые содержаться в пище (больше всего, разумеется в печени и почках, красном мясе).
2. Синтез пуриновых оснований самим организмом
. Большая часть синтезируется в гепатоцитах печени. Очень важный пункт, к нему вернемся. А также причем здесь рекомендуемая диабетиками и не требующая для усвоения инсулина фруктоза.
3. Пуриновые основания, которые образуются в организме вследствие распада тканей: при онкопроцессах, псориазе
. Почему у спортсменов может повышаться мочевая кислота? Это и есть третий путь. Тяжелые физические нагрузки приводят к усилению процессов распада и синтеза тканей. Если вы накануне занимались тяжелым физическим трудом, а утром вы сдаете анализ, уровень мочевой кислоты может быть выше вашего среднего значения. Знакомимся: аденин и гуанин. Это и есть пуриновые основания. Совместно с тимином и цитозином формируют спираль ДНК. Студенты медики не любят — зубрежка на курсе биохимии:). Как известно, ДНК состоит из двух цепочек. Напротив аденина всегда становится тимин, напротив гуанина — цитозин. Две цепочки ДНК склеиваются как две половинки застежки-молнии. Количество этих веществ повышается при активном распаде тканей, как бывает, например, при онкопроцессах
Знакомимся: аденин и гуанин. Это и есть пуриновые основания. Совместно с тимином и цитозином формируют спираль ДНК. Студенты медики не любят — зубрежка на курсе биохимии:). Как известно, ДНК состоит из двух цепочек. Напротив аденина всегда становится тимин, напротив гуанина — цитозин. Две цепочки ДНК склеиваются как две половинки застежки-молнии. Количество этих веществ повышается при активном распаде тканей, как бывает, например, при онкопроцессах
Рядом последовательных химических реакций пурины преобразуются в мочевую кислоту.

Метаболизм мочевой кислоты у человека и приматов
Планировал максимально упростить для понимания схему. Пусть учат студенты-медики на 2 курсе:). Но названия ферментов оставил. Самый важный момент — фермент ксантиноксидаза
. Именно его активность падает при лечении аллопуринолом
(точнее эффективность, так как аллопуринол с ним конкурирует за рецептор), чем и снижается синтез мочевой кислоты.
Редко, но всречаются врожденное заболевание,сопровождающееся генетическим нарушением в синтезе ксантиноксидазы, при котором уровень мочевой кислоты снижен. В таком случае накапливаются ксантин и гипоксантин. Ксантинурия. Казалось бы ну и хорошо, меньше мочевой кислоты. Однако выяснилось, что мочевая кислота не только вредна, но и полезна…
Разговор о вреде и пользе мочевой кислоты следует начать очень издалека. Тогда, 17 миллионов лет назад, в эпоху миоцена у наших предков произошла мутация в гене, который продуцирует фермент — уриказу. И нам досталась «урезанная» версия пуринового обмена.
 У других млекопитающих уриказа переводит мочевую кислоту в растворимый и легко выводящийся из организма аллантоин. И у этих животных никогда не бывает подагры. Может возникнуть предположение, что в этой мутации нет никакого смысла. Но эволюция этот ген не исключила: мутация оказалась необходимой.
У других млекопитающих уриказа переводит мочевую кислоту в растворимый и легко выводящийся из организма аллантоин. И у этих животных никогда не бывает подагры. Может возникнуть предположение, что в этой мутации нет никакого смысла. Но эволюция этот ген не исключила: мутация оказалась необходимой.
Современные исследования показали, что мочевая кислота является побочным продуктом разложения фруктозы в печени и накопление солей мочевой кислоты способствует эффективному превращению фруктозы в жир. Таким образом, у наших предков в геноме закрепился ген «бережливости». Тогда ген был необходим для создания запасов на голодный период. Было доказано, что окончательная инактивация уриказы совпала с глобальным похолоданием климата на Земле. Нужно было «наесть» как можно больше запасов подкожного жира на холодный период, перевести содержащуюся в плодах фруктозу в жировой запас. Сейчас проводятся ряд экспериментов с введением в клетки печени фермента уриказы. Не исключено, что в дальнейшем на основе фермента уриказы появятся препараты для лечения подагры. Так что склонность к ожирению у нас заложена в генах. На несчастье тем многим мужчинам и женщинам, страдающим полнотой. Но проблема не только в генетике. Изменился характер питания современного человека.
Известно, что постоянный уровень мочевой кислоты способен значительно повысить риск ряда заболеваний. Однако доказано, что периодическое повышение уровня мочевой кислоты может оказывать положительное действие. Исторически доступ к мясной пище (основному источнику пуринов), был нерегулярным. Основная пища: различные коренья, плоды деревьев. Ну а если принесет первобытный охотник добычу — так это праздник. Поэтому, периодическое от мясных продуктов было обычным образом жизни. Есть добыча — едим до отвала. Нет добычи — едим растительную пищу. Сейчса установлено, что кратковременное, периодическое повышение уровня мочевой кислоты благоприятно вляет на развитие и функцию нервной системы. Может поэтому и начал развиваться мозг?
Пути два: почки и печень
Основной путь — выведение с почками — это 75%
25 процентов выводится печенью с помощью желчи. Поступившая в просвет кишечника мочевая кислота и разрушается (спасибо нашим бактериям в кишечнике).
В почки мочевая кислота попадает в виде натриевой соли. При ацидозе (закислении мочи) в почечных лоханках могут формироваться микролиты. Тот самый «песок» и «камни». Кстати алкоголь очень сильно снижает экскрецию уратов с мочой. Почему и приводит к приступу подагры.
1. Стараться в неделю 1-2 дня делать чисто вегетарианским
2. Наибольшее количество пуринов содержится в тканях животного происхождения. Причем в животных клетках с активным метаболизмом: печени, почках — больше всего.
3. Нужно есть меньше жирной пищи, так как избыток насыщенных жиров подавляет способность организма перерабатывать мочевую кислоту.
4. Едим поменьше фруктозы. Мочевая кислота — продукт метаболизма фруктозы. Ранее пациентам с сахарным диабетом рекомендовали заменять глюкозу на фруктозу. Действительно, фруктоза для своего усвоения не требует участия инсулина. Но для усвоения фруктоза еще тяжелее. Внимание: в сахаре молекула сахарозы — это дисахарид — глюкоза + фруктоза. Так что сахара едим меньше.
5. Исключить прием алкоголя, особенно пива. Вино в небольших количествах не влияет на уровень мочевой кислоты.
6. Очень интенсивные физические нагрузки повышают уровень мочевой кислоты.
7. Нужно пить много воды. Это позволит эффективно выводить мочевую кислоту.
Ну во первых, к счастью это не всегда является патологией: кратковременный подъем может быть вариантом нормы
Если все же проблема есть, нужно разобраться, на каком уровне есть нарушение (та самая первая схема): нарушения в синтезе пуринов (тот самый метаболический синдром), алиментарный фактор (много мяса кушаем, пивом запиваем), нарушение функции почек (нарушение экскреции мочевой кислоты)или сопутствующие заболевания, сопровождающиеся разрушением тканей.
Удачи Вам и грамотных докторов.
Если вы нашли опечатку в тексте, пожалуйста, сообщите мне об этом. Выделите фрагмент текста и нажмите Ctrl+Enter .
Класс Земноводные = Амфибии.
Первые наземные позвоночные, еще сохранившие связь с водной средой. Класс насчитывает 3900 видов и включает 3 отряда: хвостатые (саламандры, тритоны), безногие (тропические червяги) и бесхвостые (жабы, квакши, лягушки, и др.).
Вторично-водные животные. Поскольку в яйце отсутствует амниотическая полость (вместе с круглоротыми и рыбами амфибии относятся к анамниям), они размножаются в воде, где проходят начальные этапы их развития. На разных стадиях жизненного цикла земноводные ведут наземный или полуводный образ жизни, распространены практически повсеместно, преимущественно в районах с высокой влажностью по берегам пресных водоемов и на сырых почвах. Среди земноводных нет форм, которые могли бы жить в соленой морской воде. Характерны различные способы передвижения: известны виды, совершающие довольно длинные прыжки, передвигающиеся шагом или «ползающие», лишенные конечностей (червяги).
Основные признаки земноводных.
Амфибии сохранили многие черты своих чисто водных предков, но наряду с этим приобрели и ряд признаков, свойственных настоящим наземным позвоночным.
Для хвостатых и бесхвостых характерно личиночное развитие с жаберным дыханием в пресной воде (головастики лягушки) и их метаморфоз во взрослую особь, дышащую легкими. У безногих по вылуплении личинка принимает вид взрослого животного.
Кровеносная система характеризуется двумя кругами кровообращения. Сердце трехкамерное. Имеет один желудочек и два предсердия.
Обособляются шейный и крестцовый отделы позвоночника, имеющие по одному позвонку.
Для взрослых земноводных характерны парные конечности с шарнирными суставами. Конечности пятипалые.
Череп двумя затылочными мыщелками подвижно сочленяется с шейным позвонком.
Тазовый пояс плотно причленяется к поперечным отросткам крестцового позвонка.
Глаза имеют подвижные веки и мигательные перепонки для предохранения глаз от засорения и высыхания. За счет выпуклой роговицы и уплощенного хрусталика улучшается аккомодация.
Передний мозг увеличивается и разделяется на два полушария. Средний мозг и мозжечок развиты незначительно. От головного мозга отходит 10 пар черепно – мозговых нервов.
Кожа голая, т.е. лишена каких – либо роговых или костных образований, проницаема для воды и газов. Поэтому она всегда влажная – кислород сначала растворяется в жидкости, покрывающей кожу, после чего диффундирует в кровь. То же самое происходит с углекислым газом, но в обратном направлении.
Почки, как у рыб, первичные = мезонефрические.
Для улавливания звуковых волн воздушной среды появляется барабанная перепонка, за ней - среднее ухо (барабанная полость), в котором располагается слуховая косточка – стремя, которая проводит колебания к внутреннему уху. Евстахиевой трубой полость среднего уха сообщается с ротовой полостью. Появляются хоаны – внутренние ноздри, носовые ходы становятся сквозными.
Температура тела непостоянная (пойкилотермия) зависит от температуры окружающей среды и лишь слегка превышает последнюю.
Ароморфозы:
Появились легкие и легочное дыхание.
Усложнилась кровеносная система, развился легочный круг кровообращения, т.е. у амфибий два круга кровообращения – большой и малый. Сердце трехкамерное.
Сформировались парные пятипалые конечности, представляющие собой систему рычагов с шарнирными суставами и предназначенные для передвижения по суше.
Образовался шейный отдел в позвоночнике, обеспечивающий движение головы, и крестцовый отдел – место прикрепления тазового пояса.
Появились среднее ухо, веки, хоаны.
Дифференцировка мышц.
Прогрессивное развитие нервной системы.
Филогения.
Земноводные произошли от древних кистеперых рыб в девонском периоде палеозойской эры примерно 350 млн. лет назад. Первые земноводные – ихтиостеги – по внешнему виду напоминали современных хвостатых амфибий. В их строении были черты, свойственные рыбам, в том числе рудименты жаберной крышки и органы боковой линии.
Покров. Двухслойный. Эпидермис многослойный, кориум – тонкий, но обильно снабжен капиллярами. У земноводных сохранилась способность вырабатывать слизь, но не отдельными клетками, как у большинства рыб, а оформленными слизистыми железами альвеолярного типа. Кроме того, у амфибий часто имеются зернистые железы с ядовитым секретом разной степени токсичности. Цвет кожи амфибий зависит от особых клеток – хроматофоров. К их числу принадлежат меланофоры, липофоры и иридоциты.
Под кожей у лягушек имеются обширные лимфатические лакуны – резервуары, заполненные тканевой жидкостью и позволяющие при неблагоприятных условиях накапливать запас воды.
Скелет подразделяется на осевой и добавочный, как у всех позвоночных. Позвоночный столб более дифференцирован на отделы, чем у рыб и состоит из четырех отделов: шейного, туловищного, крестцового и хвостового. Шейный и крестцовый отделы имеют по одному позвонку. Туловищных позвонков у бесхвостых обычно семь, а все хвостовые позвонки (примерно 12) сливаются в единую косточку – уростиль. У хвостатых 13 – 62 туловищных и 22 – 36 хвостовых позвонков; у безногих общее число позвонков доходит до 200 – 300. Наличие шейного позвонка важно, т.к. в отличие от рыб, земноводные не могут так быстро разворачивать свое тело, а шейный позвонок делает голову подвижной, но с малой амплитудой. Амфибии не могут поворачивать голову, но могут ее наклонять.
Позвонки у разных амфибий могут различаться по своему типу. У безногих и низших хвостатых позвонки амфицельные, с сохранившейся хордой, как у рыб. У высших хвостатых позвонки опистоцельные, т.е. спереди тела выгнуты, а сзади вогнуты. У бесхвостых, наоборот, передняя поверхность тел позвонков вогнута, а задняя выгнута. Такие позвонки называются процельными. Наличие сочленовных поверхностей и сочленовных отростков обеспечивает не только прочное соединение позвонков, но и делает осевой скелет подвижным, что важно для передвижения хвостатых амфибий в воде без участия конечностей, за счет боковых изгибов тела. Кроме того, возможны вертикальные движения.
Череп амфибий представляет собой как бы видоизмененный череп костистой рыбы, приспособленный к наземному существованию. Мозговой череп пожизненно сохраняется преимущественно хрящевым. Затылочная область черепа содержит только две боковые затылочные кости, которые несут по сочленовному мыщелку, с помощью которых череп крепится к позвонкам. Висцеральный череп амфибий претерпевает наибольшие преобразования: возникают вторичные верхние челюсти; образованные межчелюстными (предчелюстными) и верхнечелюстными костями. Редукция жаберного дыхания привела к радикальному изменению подъязычной дуги. Подъязычная дуга преобразуется в элемент слухового аппарата и подъязычную пластинку. В отличие от рыб, висцеральный череп амфибий непосредственно прирастает небно-квадратным хрящом ко дну мозгового черепа. Такой тип прямого соединения компонентов черепа без участия элементов подъязычной дуги называется аутостилией. Элементы жаберной крышки у амфибий отсутствуют.
Добавочный скелет включает в себя кости поясов и свободных конечностей. Как и у рыб, кости плечевого пояса амфибий находятся в толще мышц, которые связывают их с осевым скелетом, но сам пояс не связан с осевым скелетом непосредственно. Пояс обеспечивает опору для свободной конечности.
Всем наземным животным постоянно приходится преодолевать силу тяжести, чего не нужно делать рыбам. Свободная конечность служит опорой, позволяет приподнять тело над поверхностью и обеспечивает перемещение. Свободные конечности состоят из трех отделов: проксимального (одна кость), промежуточного (две кости) и дистального (относительно большое число костей). У представителей разных классов наземных позвоночных встречаются особенности строения той или иной свободной конечности, но все они носят вторичный характер.
У всех амфибий проксимальный отдел свободной передней конечности представлен плечевой костью, промежуточный – локтевой и лучевой костями у хвостатых и единой костью предплечья (она образована в результате сращения локтевой и лучевой кости) у бесхвостых. Дистальный отдел образован запястью, пястью и фалангами пальцев.
Пояс задних конечностей сочленяется непосредственно с осевым скелетом, с его крестцовым отделом. Надежное и жесткое соединение тазового пояса с позвоночным столбом обеспечивает работу задних конечностей, которые более важны для перемещения амфибий.
Мышечная система отличается от мышечной системы рыб. Туловищная мускулатура сохраняет метамерное строение только у безногих. У хвостатых метамерия сегментов нарушается, а у бесхвостых амфибий начинают обособляться участки мышечных сегментов, дифференцируясь в лентовидные мышцы. Резко возрастает масса мускулатуры конечностей. У рыб движения плавников обеспечиваются главным образом мышцами, расположенными на туловище, тогда как пятипалая конечность двигается за счет мышц, расположенной в ней самой. Появляется сложная система мускулов – антагонистов – мышц сгибателей и разгибателей. Сегментированная мускулатура имеется только в области позвоночного столба. Усложняется и специализируется мускулатура ротовой полости (жевательная, языка, дна ротовой полости), не только участвующая в захвате и проглатывании пищи, но и обеспечивающая вентиляцию ротовой полости и легких.
Полость тела – целом. У земноводных в связи с исчезновением жабр изменилось относительное положение перикардиальной полости. Ее вытолкнуло на дно грудной клетки в зону, прикрывающуюся грудиной (или коракоидом). Над ней в паре целомических каналов лежат легкие. Полости, вмещающие сердце и легкие. Разделяет плеврокардиальная перепонка. Полость, в которой располагаются легкие, сообщается с главным целомом.
Нервная система. Головной мозг ихтиопсидного типа, т.е. главным интегрирующим центром является средний мозг, но мозг амфибий имеет ряд прогрессивных изменений. Мозг амфибий имеет пять отделов и отличается от мозга рыб, главным образом, большим развитием переднего мозга, полным разделением его полушарий. Кроме того, нервное вещество уже выстилает кроме дна боковых желудочков также бока и крышу, образуя мозговой свод – архипаллиум. Развитие архипаллиума, сопровождающееся усилением связей с промежуточным и особенно средним мозгом, приводит к тому, что ассоциативная деятельность, регулирующая поведение, осуществляется у земноводных не только продолговатым и средним мозгом, но и полушариями переднего мозга. Удлиненные полушария спереди имеют общую обонятельную долю, от которой берут начало два обонятельных нерва. Позади переднего мозга находится промежуточный мозг. На его крыше располагается эпифиз. На нижней стороне мозга имеется перекрест зрительных нервов (хиазма). От дна промежуточного мозга отходит воронка и гипофиз (нижняя мозговая железа).
Средний мозг представлен в виде двух круглых зрительных долей. Сзади зрительных долей лежит слаборазвитый мозжечок. Сразу же за ним расположен продолговатый мозг с ромбовидной ямкой (четвертый желудочек). Продолговатый мозг постепенно переходит в спинной мозг.
У земноводных от головного мозга отходит 10 пар головных нервов. Одиннадцатая пара не развита, а двенадцатая отходит за пределами черепа.
Настоящих спинномозговых нервов у лягушки 10 пар. Три передние принимают участие в образовании плечевого сплетения, иннервирующего передние конечности, а четыре задние пары – в образовании пояснично-крестцового сплетения, иннервирующего задние конечности.
Органы чувств обеспечивают ориентировку земноводных в воде и на суше.
Органы боковой линии есть у всех личинок и у взрослых с водным образом жизни. Представлены скоплением чувствительных клеток с подходящими к ним нервами, которые разбросаны по всему телу. Чувствительные клетки воспринимают температурные, болевые, тактильные ощущения, а также изменение влажности и химического состава окружающей среды.
Органы обоняния. У амфибий с каждой стороны головы имеется небольшая наружная ноздря, которая ведет в удлиненный мешок, заканчивающийся внутренней ноздрей (хоаной). Хоаны открываются в передней части крыши ротовой полости. Спереди от хоан слева и справа имеется по мешку, которые открываются в носовую полость. Это т.н. вомероназальный орган. В нем большое количество сенсорных клеток. Его функция состоит в получении обонятельной информации о пище.
Органы зрения имеют строение, характерное для наземного позвоночного. Это выражается в выпуклой форме роговицы, хрусталике в виде двояковыпуклой линзы, в подвижных веках, защищающих глаза от высыхания. Но аккомодация, как и у рыб, достигается перемещением хрусталика путем сокращения ресничной мышцы. Мышца располагается в кольцевом валике, окружающем хрусталик, и при ее сокращение хрусталик лягушки несколько выдвигается вперед.
Орган слуха устроен по наземному типу. Появляется второй отдел – среднее ухо, в котором помещается впервые появляющаяся у позвоночных слуховая косточка – стремя. Барабанная полость соединена с глоточной областью евстахиевой трубой.
Поведение земноводных весьма примитивно, условные рефлексы вырабатываются медленно, а угасают быстро. Двигательная специализация рефлексов очень мала, поэтому лягушка не может сформировать защитный рефлекс отдергивания одной лапки, и при раздражении одной конечности она дергает обеими лапками.
Пищеварительная система начинается ротовой щелью, ведущей в ротоглоточную полость. В ней располагается мускулистый язык. В нее открываются протоки слюнных желез. Язык и слюнные железы впервые появляются у амфибий. Железы служат только для смачивания пищевого комка и в химической обработке пищи не участвуют. На межчелюстных, верхнечелюстных костях, сошнике располагаются простые конические зубы, которые основанием прикрепляются к кости. Пищеварительная трубка дифференцируется на ротоглоточную полость, короткий пищевод, выполняющий функцию проведения пищи в желудок, и объемистый желудок. Пилорическая его часть переходит в двенадцатиперстную кишку – начало тонкого кишечника. В петле между желудком и двенадцатиперстной кишкой лежит поджелудочная железа. Тонкая кишка плавно переходит в толстую кишку, которая заканчивается выраженной прямой кишкой, открывающейся в клоаку.
Пищеварительными железами являются печень с желчным пузырем и поджелудочная железа. Протоки печени вместе с протоком желчного пузыря открываются в двенадцатиперстную кишку. Протоки поджелудочной железы впадают в проток желчного пузыря, т.е. самостоятельного сообщения с кишечником эта железа не имеет.
Т.о. пищеварительная система амфибий отличается от аналогичной системы рыб большей длиной пищеварительного тракта, конечный отдел толстой кишки открывается в клоаку.
Кровеносная система замкнутая. Два круга кровообращения. Сердце трехкамерное. Кроме того, в сердце имеется венозный синус, сообщающийся с правым предсердием, а с правой стороны желудочка отходит артериальный конус. От него отходят три пары сосудов, гомологичных жаберным артериям рыб. Каждый сосуд начинается самостоятельным отверстием. Все три сосуда левой и правой стороны идут вначале общим артериальным стволом, окруженным общей оболочкой, а затем разветвляются.
Сосуды первой пары (считая от головы), гомологичные сосудам первой пары жаберных артерий рыб, называются сонными артериями, которые несут кровь к голове. По сосудам второй пары (гомологичным второй паре жаберных артерий рыб) – дугам аорты – кровь направляется к задней части тела. От дуг аорты отходят подключичные артерии, несущие кровь к передним конечностям.
По сосудам третьей пары, гомологичным четвертой паре жаберных артерий рыб – легочным артериям – кровь направляется в легкие. От каждой легочной артерии отходит крупная кожная артерия, по которой кровь направляется в кожу для окисления.
Венозная кровь от переднего конца тела собирается по двум парам яремных вен. Последняя, сливаясь с кожными венами, уже принявшими в себя подключичные вены, образует две передние полые вены. Они несут в венозный синус смешанную кровь, поскольку по кожным венам движется артериальная кровь.
У личинок земноводных один круг кровообращения, их кровеносная система подобна кровеносной системе рыб.
У амфибий появляется новый орган кровообращения – красный костный мозг трубчатых костей. Эритроциты крупные, ядерные, лейкоциты неодинаковы по внешнему виду. Есть лимфоциты.
Лимфатическая система. Кроме лимфатических мешков, расположенных под кожей, имеются лимфатические сосуды и сердца. Одна пара лимфатических сердец помещается около третьего позвонка, другая – вблизи клоачного отверстия. Селезенка, имеющая вид небольшого круглого тела красного цвета, располагается на брюшине вблизи начала прямой кишки.
Дыхательная система. Принципиально отличается от дыхательной системы рыб. У взрослых особей органами дыхания являются легкие и кожа. Дыхательные пути в связи с отсутствием шейного отдела короткие. Представлены носовой и ротоглоточной полостями, а также гортанью. Гортань открывается непосредственно в легкие двумя отверстиями. Вследствие редукции ребер легкие наполняются посредством заглатывания воздуха – по принципу нагнетательного насоса.
Анатомически дыхательная система амфибий включает в себя ротоглоточную полость (верхние воздухоносные пути) и гортанно – трахеальную полость (нижние пути), которая непосредственно переходит в мешковидные легкие. Легкое в процессе эмбрионального развития образуются как слепой вырост переднего (глоточного) отдела пищеварительной трубки, поэтому и во взрослом состоянии остается связанным с глоткой.
Т.о. дыхательная система у наземных позвоночных анатомически и функционально подразделяется на два отдела – систему воздухоносных путей и респираторный отдел. Воздухоносные пути осуществляют двусторонний транспорт воздуха, но не участвуют в самом газообмене, респираторный отдел осуществляет газообмен между внутренней средой организма (кровью) и атмосферным воздухом. Газообмен происходит через поверхностную жидкость и идет пассивно в соответствии с градиентом концентрации.
Система жаберных крышек становится ненужной, поэтому жаберный аппарат у всех наземных животных частично видоизменяется, его скелетные структуры частично входят в состав скелета (хрящей) гортани. Вентиляция легких осуществляется за счет принудительных движений специальной соматической мускулатуры в процессе дыхательного акта.
Выделительная система, как и у рыб, представлена первичными, или туловищными почками. Это компактные тела красновато – коричневого цвета, лежащие по бокам позвоночника, а не лентовидные, как у рыб. От каждой почки тянется к клоаке тонкий вольфов канал. У самок лягушек он служит только мочеточником, а у самцов и мочеточником и семяпроводом. В клоаку вольфовы каналы открываются самостоятельными отверстиями. Также отдельно открывается в клоаку и мочевой пузырь. Окончательным продуктом азотистого обмена у амфибий является мочевина. У водных личинок амфибий основным продуктом азотистого обмена является аммиак, который в виде раствора выводится через жабры и кожу.
Амфибии – гиперосмотические животные по отношению к пресной воде. Вследствие этого вода постоянно поступает в организм через кожу, которая не имеет механизмов, препятствующих этому, как у других наземных позвоночных. Морская вода гиперосмотична по отношению к осмотическому давлению в тканях земноводных, при помещении их в такую среду вода через кожу будет уходить из организма. Вот почему земноводные не могут жить в морской воде и погибают в ней от обезвоживания.
Половая система. У самцов органы размножения представлены парой округлых беловатых семенников, прилегающих к брюшной поверхности почек. От семенников к почкам тянутся тонкие семявыводящие канальцы. Половые продукты из семенника через эти канальцы направляются в тела почек, далее в вольфовы каналы и по ним в клоаку. Перед впадением в клоаку вольфовы каналы образуют небольшое расширение – семенные пузырьки, служащие для временного депонирования спермы.
Органы размножения самок представлены парными яичниками зернистого строения. Сверху над ними располагаются жировые тела. В них накапливаются питательные вещества, обеспечивающие формирование половых продуктов во время зимней спячки. В боковых частях полости тела расположены сильно извитые светлые яйцеводы, или мюллеровы каналы. Каждый яйцевод в полость тела в области сердца открывается воронкой; нижняя маточная часть яйцеводов резко расширена и открывается в клоаку. Созревшие яйца через разрыв стенок яичника выпадают в полость тела, затем захватываются воронками яйцеводов и по ним перемещаются в клоаку.
Вольфовы каналы у самок выполняют только функции мочеточников.
У бесхвостых земноводных оплодотворение наружное. Икринка сразу же орошаются семенной жидкостью.
Наружные половые признаки самцов:
У самцов на внутреннем пальце передних конечностей имеется половая бородавка, которая достигает особенного развития ко времени размножения и помогает самцам удерживать самок при оплодотворении икры.
Самцы обычно меньше самок.
Развитие земноводных сопровождается метаморфозом. Яйца содержат относительно немного желтка (мезолецитальные яйца), поэтому происходит радиальное дробление. Из яйца выходит личинка – головастик, которая по своей организации значительно ближе к рыбам, чем к взрослым амфибиям. Он имеет характерную рыбообразную форму - длинный хвост, окруженный хорошо развитой плавательной перепонкой, по бокам головы у него есть две – три пары наружных перистых жабр, парные конечности отсутствуют; имеются органы боковой линии, функционирующей почкой является пронефрос (предпочка). Вскоре наружные жабры исчезают, а взамен их развиваются три пары жаберных щелей с их жаберными лепесточками. В это время сходством головастика с рыбой является также двухкамерное сердце, один круг кровообращения. Затем путем выпячивания из брюшной стенки пищевода развиваются парные легкие. На этой стадии развития артериальная система головастика чрезвычайно похожа на артериальную систему кистеперых и двоякодышащих рыб, и все отличие сводится к тому, что благодаря отсутствию четвертой жабры четвертая приносящая жаберная артерия без перерыва переходит в легочную артерию. Еще позже жабры редуцируются. Впереди жаберных щелей с каждой стороны образуется складка кожи, которая, постепенно разрастаясь назад, затягивает эти щели. Головастик переходи всецело на легочное дыхание и заглатывает ртом воздух. В дальнейшем у головастика формируется парные конечности – сперва передние, потом задние. Однако передние находятся дольше скрытыми под кожей. Хвост и кишечник начинают укорачиваться, появляется мезонефрос, личинка постепенно переходит от растительной пищи к животной и превращается в молодую лягушку.
В ходе развития личинки у нее перестраиваются внутренние системы: дыхательная, кровеносная, выделительная, пищеварительная. Метаморфоз завершается формированием миниатюрной копии взрослой особи.
Для амбистом характерная неотения, т.е. у них размножаются личинки, которых длительное время принимали за самостоятельный вид, поэтому у них есть свое название – аксолотль. Такая личинка крупнее взрослой особи. Другой интересной группой являются протеи, постоянно живущие в воде, которые в течение всей жизни сохраняют наружные жабры, т.е. признаки личинки.
Метаморфоз головастика в лягушку представляет огромный теоретический интерес, т.к. не только доказывает, что земноводные произошли от рыбообразных существ, но дает возможность в подробностях восстановить эволюцию отдельных систем органов, в частности систем кровообращения и дыхания, при переходе водных животных в наземные.
Значение земноводных состоит в том, что они поедают многих вредных беспозвоночных и сами служат пищей другим организмам в цепях питания.
Вопрос полный
Азотистый обмен
Азотистый обмен - совокупность химических превращений, реакций синтеза и распада азотистых соединений в организме; составная часть обмена веществ и энергии. Понятие «азотистый обмен» включает в себя белковый обмен (совокупность химических превращений в организме белков и продуктов их метаболизма), а также обмен пептидов, аминокислот , нуклеиновых кислот , нуклеотидов, азотистых оснований, аминосахаров (см. Углеводы), азотсодержащих липидов , витаминов , гормонов и других соединений, содержащих азот.
Организм животных и человека усвояемый азот получает с пищей, в которой основным источником азотистых соединений являются белки животного и растительного происхождения. Главным фактором поддержания азотистого равновесия - состояния А. о., при котором количество вводимого и выводимого азота одинаково, - служит адекватное поступление белка с пищей. В СССР суточная норма белка в питании взрослого человека принята равной 100 г , или 16 г азота белка, при расходе энергии 2500 ккал . Азотистый баланс (разность между количеством азота, который попадает в организм с пищей, и количеством азота, выводимого из организма с мочой, калом, потом) является показателем интенсивности А. о. в организме. Голодание или недостаточное по азоту питание приводят к отрицательному азотистому балансу, или азотистому дефициту, при котором количество азота, выводимого из организма, превышает количество азота, поступающего в организм с пищей. Положительный азотистый баланс, при котором вводимое с пищей количество азота превышает количество азота, выводимое из организма, наблюдается в период роста организма, при процессах регенерации тканей и т.д. Состояние А. о. в значительной степени зависит от качества пищевого белка, которое, в свою очередь, определяется его аминокислотным составом и прежде всего наличием незаменимых аминокислот.
Принято считать, что у человека и позвоночных животных А. о. начинается с переваривания азотистых соединений пищи в желудочно-кишечном тракте. В желудке происходит расщепление белков при участии пищеварительных протеолитических ферментов трипсина и гастриксина (см. Протеолиз ) с образованием полипептидов, олигопептидов и отдельных аминокислот. Из желудка пищевая масса поступает в двенадцатиперстную кишку и нижележащие отделы тонкой кишки, где пептиды подвергаются дальнейшему расщеплению, катализируемому ферментами сока поджелудочной железы трипсином, химотрипсином и карбоксипептидазой и ферментами кишечного сока аминопептидазами и дипептидазами (см. Ферменты ). Наряду с пептидами. в тонкой кишке расщепляются сложные белки (например, нуклеопротеины) и нуклеиновые кислоты. Существенный вклад в расщепление азотсодержащих биополимеров вносит и микрофлора кишечника. Олигопептиды, аминокислоты, нуклеотиды, нуклеозиды и др. всасываются в тонкой кишке, поступают в кровь и с ней разносятся по всему организму. Белки тканей организма в процессе постоянного обновления также подвергаются протеолизу под действием тканевых протсаз (пептидаз и катепсинов), а продукты распада тканевых белков попадают в кровь. Аминокислоты могут быть использованы для нового синтеза белков и других соединений (пуриновых и пиримидиновых оснований, нуклеотидов, порфиринов и т.д.), для получения энергии (например, посредством включения в цикл трикарбоновых кислот) или могут быть подвергнуты дальнейшей деградации с образованием конечных продуктов А. о., подлежащих выведению из организма.
Аминокислоты, поступающие в составе белков пищи, используются для синтеза белков органов и тканей организма. Они участвуют также в образовании многих других важных биологических соединений: пуриновых нуклеотидов (глутамин, глицин, аспарагиновая кислота) и пиримидиновых нуклеотидов (глутамин, аспарагиновая кислота), серотонина (триптофан), меланина (фенилалпнин, тирозин), гистамина (гистидин), адреналина, норадреналина, тирамина (тирозин), полиаминов (аргинин, метионин), холина (метионин), порфиринов (глицин), креатина (глицин, аргинин, метионин), коферментов, сахаров и полисахаридов, липидов и т.д. Важнейшей для организма химической реакцией, в которой участвуют практически все аминокислоты, является трансаминирование, заключающееся в обратимом ферментативном переносе a-аминогруппы аминокислот на a-углеродный атом кетокислот или альдегидов. Трансаминирование является принципиальной реакцией биосинтеза заменимых аминокислот в организме. Активность ферментов, катализирующих реакции трансаминирования, - аминотрансфераз - имеет большое клинико-диагностическое значение.
Деградация аминокислот может протекать по нескольким различным путям. Большинство аминокислот способно подвергаться декарбоксилированию при участии ферментов декарбоксилаз с образованием первичных аминов, которые затем могут окисляться в реакциях, катализируемых моноаминоксидазой или диаминоксидазой. При окислении биогенных аминов (гистамина, серотонина, тирамина, g-аминомасляной кислоты) оксидазами образуются альдегиды, подвергающиеся дальнейшим превращениям, и аммиак , основным путем дальнейшего метаболизма которого является образование мочевины.
Другим принципиальным путем деградации аминокислот является окислительное дезаминирование с образованием аммиака и кетокислот. Прямое дезаминирование L-аминокислот в организме животных и человека протекает крайне медленно, за исключением глутаминовой кислоты, которая интенсивно дезаминируется при участии специфического фермента глутаматдегидрогеназы. Предварительное трансаминирование почти всех a-аминокислот и дальнейшее дезаминирование образовавшейся глутаминовой кислоты на a-кетоглутаровую кислоту и аммиак является основным механизмом дезаминирования природных аминокислот.
Продуктом разных путей деградации аминокислот является аммиак, который может образовываться и в результате метаболизма других азотсодержащих соединений (например, при дезаминировании аденина, входящего в состав никотинамидадениндинуклеотида - НАД). Основным путем связывания и нейтрализации токсичного аммиака у уреотелических животных (животные, у которых конечным продуктом А. о, является мочевина) служит так называемый цикл мочевины (синоним: орнитиновый цикл, цикл Кребса - Гензелейта), протекающий в печени. Он представляет собой циклическую последовательность ферментативных реакций, в результате которой из молекулы аммиака или амидного азота глутамина, аминогруппы аспарагановой кислоты и диоксида углерода осуществляется синтез мочевины. При ежедневном потреблении 100 г белка суточное выведение мочевины из организма составляет около 30 г . У человека и высших животных существует еще один путь нейтрализации аммиака - синтез амидов дикарбоновых кислот аспарагана и глутамина из соответствующих аминокислот. У урикотелических животных (рептилии, птицы) конечным продуктом А. о. является мочевая кислота.
В результате расщепления нуклеиновых кислот и нуклеопротеинов в желудочно-кишечном тракте образуются нуклеотиды и нуклеозиды. Олиго- и моно-нуклеотиды при участии различных ферментов (эстераз, нуклеотидаз, нуклеозидаз, фосфорилаз) превращаются затем в свободные пуриновые и пиримидиновые основания.
Дальнейший путь деградации пуриновых оснований аденина и гуанина состоит в их гидролитическом дезаминировании под влиянием ферментов аденазы и гуаназы с образованием соответственно гипоксантина (6-оксипурина) и ксантина (2,6-диоксипурина), которые затем превращаются в мочевую кислоту в реакциях, катализируемых ксантиноксидазой. Мочевая кислота - один из конечных продуктов А. о. и конечный продукт обмена пуринов у человека - выводится из организма с мочой. У большинства млекопитающих имеется фермент уриказа, который катализирует превращение мочевой кислоты в экскретируемый аллантоин.
Деградация пиримидиновых оснований (урацила, тимина) состоит в их восстановлении с образованием дигидропроизводных и последующем гидролизе, в результате которого из урацила образуется b-уреидопропионовая кислота, а из нее - аммиак, диоксид углерода и b-аланин, а из тимина - b-аминоизомасляная кислота, диоксид углерода и аммиак. Диоксид углерода и аммиак могут далее включаться в мочевину через цикл мочевины, а b-аланин участвует в синтезе важнейших биологически активных соединений - гистидинсодержащих дипептидов карнозина (b-аланил-L-гистидина) и анзерина (b-аланил-N-метил-L-гистидина), обнаруживаемых в составе экстрактивных веществ скелетных мышц, а также в синтезе пантотеновой кислоты и кофермента А.
Т.о., разнообразные превращения важнейших азотистых соединений организма связаны между собой в единый обмен. Сложный процесс А. о. регулируется на молекулярном, клеточном и тканевом уровнях. Регуляция А. о. в целом организме направлена на приспособление интенсивности А. о. к изменяющимся условиям окружающей и внутренней среды и осуществляется нервной системой как непосредственно, так и путем воздействия на железы внутренней секреции.
У здоровых взрослых людей содержание азотистых соединений в органах, тканях, биологических жидкостях находится на относительно постоянном уровне. Избыток азота, поступившего с пищей, выводится с мочой и калом, а при недостатке азота в пище нужды организма в нем могут покрываться за счет использования азотистых соединений тканей тела. При этом состав мочи изменяется в зависимости от особенностей А. о. и состояния азотистого баланса. В норме при неизменном режиме питания и относительно стабильных условиях окружающей среды из организма выделяется постоянное количество конечных продуктов А. о., а развитие патологических состояний приводит к его резкому изменению. Значительные изменения экскреции азотистых соединений с мочой, в первую очередь экскреции мочевины, могут наблюдаться и при отсутствии патологии в случае существенного изменения режима питания (например, при изменении количества потребляемого белка), причем концентрация остаточного азота (см. Азот остаточный ) в крови меняется незначительно.
При исследовании А. о. необходимо учитывать количественный и качественный состав принимаемой пищи, количественный и качественный состав азотистых соединений, выделяемых с мочой и калом и содержащихся в крови. Для исследования А. о. применяют азотистые вещества, меченные радионуклидами азота, фосфора, углерода, серы, водорода, кислорода, и наблюдают за миграцией метки и включением ее в состав конечных продуктов А. о. Широко используют меченые аминокислоты, например 15 N-глицин, которые вводят в организм с пищей или непосредственно в кровь. Значительная часть меченого азота глицина пищи выводится в составе мочевины с мочой, а другая часть метки попадает в тканевые белки и выводится из организма крайне медленно. Проведение исследования А. о. необходимо для диагностики многих патологических состояний и контроля за эффективностью лечения, а также при разработке рациональных схем питания, в т.ч. лечебного (см. Питание лечебное ).
Патологию А. о. (вплоть до очень значительной) вызывает белковая недостаточность. Ее причиной может стать общее недоедание, продолжительный дефицит белка или незаменимых аминокислот в рационе, недостаток углеводов и жиров, обеспечивающих энергией процессы биосинтеза белка в организме. Белковая недостаточность может быть обусловлена преобладанием процессов распада белков над их синтезом не только в результате алиментарного дефицита белка и других важнейших пищевых веществ, но и при тяжелой мышечной работе, травмах, воспалительных и дистрофических процессах, ишемии, инфекции, обширных ожогах, дефекте трофической функции нервной системы, недостаточности гормонов анаболического действия (гормона роста, половых гормонов, инсулина), избыточном синтезе или избыточном поступлении извне стероидных гормонов и т.п. Нарушение усвоения белка при патологии желудочно-кишечного тракта (ускоренная эвакуация пищи из желудка, гипо- и анацидные состояния, закупорка выводного протока поджелудочной железы, ослабление секреторной функции и усиление моторики тонкой кишки при энтеритах и энтероколитах, нарушение процесса всасывания в тонкой кишке и др.) также может приводить к белковой недостаточности. Белковая недостаточность ведет к дискоординации А. о. и характеризуется резко выраженным отрицательным азотистым балансом.
Известны случаи нарушения синтеза определенных белков (см. Иммунопатология , Ферментопатии ), а также генетически обусловленного синтеза аномальных белков, например при гемоглобинопатиях , миеломной болезни (см. Парапротеинемические гемобластозы ) и др.
Патология А. о., заключающаяся в нарушении обмена аминокислот, часто связана с аномалиями процесса трансаминирования: уменьшением активности аминотрансфераз при гипо- или авитаминозах В 6 , нарушением синтеза этих ферментов, недостатком кетокислот для трансаминирования в связи с угнетением цикла трикарбоновых кислот при гипоксии и сахарном диабете и т.д. Снижение интенсивности трансаминирования приводит к угнетению дезаминирования глутаминовой кислоты, а оно, в свою очередь, - к повышению доли азота аминокислот в составе остаточного азота крови (гипераминоацидемии), общей гиперазотемии и аминоацидурии. Гипераминоацидемия, аминоацидурия и общая азотемия характерны для многих видов патологии А. о. При обширных поражениях печени и других состояниях, связанных с массивным распадом белка в организме, нарушаются процессы дезаминирования аминокислот и образования мочевины таким образом, что возрастают концентрация остаточного азота и содержание в нем азота аминокислот на фоне снижения относительного содержания в остаточном азоте азота мочевины (так называемая продукционная азотемия).
Продукционная азотемия, как правило, сопровождается выведением избытка аминокислот с мочой, поскольку даже в случае нормального функционирования почек фильтрация аминокислот в почечных клубочках происходит интенсивнее, чем их реабсорбция в канальцах. Заболевания почек, обтурация мочевых путей, нарушение почечного кровообращения приводят к развитию ретенционной азотемии, сопровождающейся нарастанием концентрации остаточного азота в крови за счет повышения содержания в крови мочевины (см. Почечная недостаточность ). Обширные раны, тяжелые ожоги, инфекции, повреждения трубчатых костей, спинного и головного мозга, гипотиреоз, болезнь Иценко - Кушинга и многие другие тяжелые заболевания сопровождаются аминоацидурией. Она характерна и для патологических состояний, протекающих с нарушением процессов реабсорбции в почечных канальцах: болезни Вильсона - Коновалова (см. Гепатоцеребральная дистрофия ), нефронофтизе Фанкони (см. Рахитоподобные болезни ) и др. Эти болезни относятся к многочисленным генетически обусловленным нарушениям А. о. Избирательное нарушение реабсорбции цистина и цистинурия с генерализованным нарушением обмена цистина на фоне общей аминоацидурии сопровождает так называемый цистиноз. При этом заболевании кристаллы цистина откладываются в клетках ретикулоэндотелиальной системы. Наследственное заболевание фенилкетонурия характеризуется нарушением превращения фенилаланина в тирозин в результате генетически обусловленной недостаточности фермента фенилаланин - 4-гидроксилазы, что вызывает накопление в крови и моче непревращенного фенилаланина и продуктов его обмена - фенилпировиноградной и фенилуксусной кислот. Нарушение превращений этих соединений характерно и для вирусного гепатита.
Тирозинемию, тирозинурию и тирозиноз отмечают при лейкозах, диффузных заболеваниях соединительной ткани (коллагенозах) и других патологических состояниях. Они развиваются вследствие нарушения трансаминирования тирозина. Врожденная аномалия окислительных превращений тирозина лежит в основе алкаптонурии, при которой в моче накапливается непревращенный метаболит этой аминокислоты - гомогентизиновая кислота. Нарушения пигментного обмена при гипокортицизме (см. Надпочечники ) связаны с угнетением превращения тирозина в меланин вследствие ингибирования фермента тирозиназы (полное выпадение синтеза этого пигмента характерно для врожденной аномалии пигментации - альбинизма).
При хроническом гепатите, сахарном диабете, остром лейкозе, хроническом миело- и лимфолейкозе, лимфогранулематозе, ревматизме и склеродермии нарушается обмен триптофана и его метаболиты 3-оксикинуренин, ксантуреновая и 3-оксиантраниловая кислоты, обладающие токсическими свойствами, накапливаются в крови. К патологии А. о. относятся и состояния, связанные с нарушением выделения почками креатинина и накоплением его в крови. Усиление экскреции креатинина сопровождает гиперфункцию щитовидной железы, а снижение экскреции креатинина при повышенном выведении креатина - гипотиреоз.
При массивном распаде клеточных структур (голодание, тяжелая мышечная работа, инфекции и др.) отмечают патологическое нарастание концентрации остаточного азота за счет увеличения относительного содержания в ней азота мочевой кислоты (в норме концентрация мочевой кислоты в крови не превышает - 0,4 ммоль/л ).
В пожилом возрасте снижаются интенсивность и объем синтеза белка за счет непосредственного угнетения биосинтетической функции организма и ослабления его способности усваивать аминокислоты пищи; развивается отрицательный азотистый баланс. Нарушения обмена пуринов у людей пожилого возраста приводят к накоплению и отложению в мышцах, суставах и хрящах солей мочевой кислоты - уратов. Коррекция нарушений А. о. в пожилом возрасте может быть осуществлена за счет специальных диет, содержащих полноценные животные белки, витамины и микроэлементы, с ограниченным содержанием пуринов.
Азотистый обмен у детей отличается рядом особенностей, в частности положительным азотистым балансом как необходимым условием роста. Интенсивность процессов А. о. на протяжении роста ребенка подвергается изменениям, особенно ярко выраженным у новорожденных и детей раннего возраста. В течение первых 3-х дней жизни азотистый баланс отрицателен, что объясняется недостаточным поступлением белка с пищей. В этот период обнаруживается транзиторное повышение концентрации остаточного азота в крови (так называемая физиологическая азотемия), иногда достигающее 70 ммоль/л ; к концу 2-й нед.
жизни концентрация остаточного азота снижается до уровня, отмечаемого у взрослых. Количество выделяемого почками азота нарастает в течение первых 3-х дней жизни, после чего снижается и вновь начинает увеличиваться со 2-й нед. жизни параллельно возрастающему количеству пищи.
Наиболее высокая усвояемость азота в организме ребенка наблюдается у детей первых месяцев жизни. Азотистый баланс заметно приближается к равновесию в первые 3-6 мес. жизни, хотя и остается положительным. Интенсивность белкового обмена у детей достаточно высока - у детей 1-го года жизни обновляется около 0,9 г белка на 1 кг массы тела в сутки, в 1-3 года - 0,8 г/кг/ сут., у детей дошкольного и школьного возраста - 0,7 г/кг/ сут.
Средние величины потребности в незаменимых аминокислотах, по данным ФАО ВОЗ (1985), у детей в 6 раз больше, чем у взрослых (незаменимой аминокислотой для детей в возрасте до 3 мес. является цистин, а до 5 лет - и гистидин). Более активно, чем у взрослых, протекают у детей процессы трансаминирования аминокислот. Однако в первые дни жизни у новорожденных из-за относительно низкой активности некоторых ферментов отмечаются гипераминоацидемия и физиологическая аминоацидурия в результате функциональной незрелости почек. У недоношенных, кроме того, имеет место аминоацидурия перегрузочного типа, т.к. содержание свободных аминокислот в плазме их крови выше, чем у доношенных детей. На первой неделе жизни азот аминокислот составляет 3-4% общего азота мочи (по некоторым данным, до 10%), и лишь к концу 1-го года жизни его относительное содержание снижается до 1%. У детей 1-го года жизни выведение аминокислот в расчете на 1 кг массы тела достигает величин выведения их у взрослого человека, экскреция азота аминокислот, достигающая у новорожденных 10 мг/кг массы тела, на 2-м году жизни редко превышает 2 мг/кг массы тела. В моче новорожденных повышено (по сравнению с мочой взрослого человека) содержание таурина, треонина, серина, глицина, аланина, цистина, лейцина, тирозина, фенилаланина и лизина. В первые месяцы жизни в моче ребенка обнаруживаются также этаноламин и гомоцитруллин. В моче детей 1-го года жизни преобладают аминокислоты пролин и [гидр]оксипролин.
Исследования важнейших азотистых компонентов мочи у детей показали, что соотношение мочевой кислоты, мочевины и аммиака в процессе роста существенно изменяется. Так, первые 3 мес. жизни характеризуются наименьшим содержанием в моче мочевины (в 2-3 раза меньше, чем у взрослых) и наибольшей экскрецией мочевой кислоты. Дети в первые три месяца жизни выделяют 28,3 мг/кг массы тела мочевой кислоты, а взрослые - 8,7 мг/кг . Относительно высокая экскреция у детей первых месяцев жизни мочевой кислоты способствует иногда развитию мочекислого инфаркта почек. Количество мочевины в моче нарастает у детей в возрасте от 3 до 6 месяцев, а содержание мочевой кислоты в это время снижается. Содержание аммиака в моче детей в первые дни жизни невелико, но затем резко возрастает и держится на высоком уровне на протяжении всего 1-го года жизни.
Характерной особенностью А. о. у детей является физиологическая креатинурия. Креатин обнаруживается еще в амниотической жидкости; в моче он определяется в количествах, превышающих содержание креатина в моче взрослых, начиная с периода новорожденности и до периода полового созревания. Суточная экскреция креатинина (дегидроксилированного креатина) с возрастом увеличивается, в то же время по мере нарастания массы тела ребенка относительное содержание азота креатинина мочи снижается. Количество креатинина, выводимого с мочой за сутки, у доношенных новорожденных составляет 10-13 мг/кг , у недоношенных 3 мг/кг , у взрослых не превышает 30 мг/кг.
При выявлении в семье врожденного нарушения А. о. необходимо проведение
Вопрос короткр
Выделение конечных продуктов азотистого обмена
Мочевая кислота является одним из наиболее важных конечных продуктов азотистого обмена у человека. В норме ее концентрация в сыворотке крови у мужчин составляет 0,27- 0,48 ммоль-л1, у женщин 0,18-0,38 ммоль-л-1; суточная экскреция с мочой колеблется от 2,3 до 4,5 ммоль (400-750 мг). У человека экскретируется мочевая кислота, у многих млекопитающих имеется фермент уриказа, которая окисляет мочевую кислоту до аллантоина. В теле здорового человека в сутки образование и выделение мочевой кислоты составляет от 500 до 700 мг. Большая часть мочевой кислоты (до 80 %) образуется в результате метаболизма эндогенных нуклеиновых кислот, лишь около 20 % связано с пуринами, поступающими с пищей. Почки за сутки экскретируют около 500 мг мочевой кислоты, 200 мг удаляются через желудочно-кишечный тракт.
Функциональные протеинурии. К функциональным протеинуриям, точные процессы возникновения которых не определены, причисляются относящаяся к вертикальному положению тела, идиопатическая непостоянное, выделение белка с мочой натуги, горячечное появление белка в моче, а также выделение белка с мочой приожирении.
Для ортостатической протеинурии свойственно появление полипептида в urina при длительном бездействии или расхаживании с скорым его исчезновением при изменении позы тела на перпендикулярное. Появление белка в моче в большинстве случаев не превосходит один г/сутки, является клубочковой и невыборочной, процедура ее появления неотчётлива. Чаще она отмечается в юношеском возрасте, у половины больных вылечивается через некоторое время. Механизм формирования, пожалуй, объединен с ненормально обострённым ответом почечного кровообращения на изменение размещения туловища.
Определение ортостатической протеинурии ставят при комбинировании ниженазванных условий:
Возраст пациентов 13-двадцать лет;
Закрытый тип появления белка в моче, неимение иных признаков нарушения почек (перестроений уринозного осадка, увеличения давления, которое кровь, находящаяся в артерии, оказывает на ее стенку, видоизменений сосудов внутренней поверхности глазного яблока);
Всего лишь ортостатический ход появления белка в моче, когда в изучениях урины, забранных после нахождения обследуемого в положении лежа (в том числе наутро до вставания с постели), протеин отсутствует.
Для доказательства этого диагноза нужно выполнить относящуюся к вертикальному положению туловища проверку. Для этого урину собирают утром перед вставанием с кровати, затем после некоторого нахождения в перпендикулярном положении (движение с палкой за спиной для развёртывания позвоночного столба). Диагностика передаёт еще более точные итоги, когда утренняя (ночная) доля urina сливается (так как в vesica urinaria возможна остаточная урина), а начальная порция подбирается после недолгого присутствия пациента в лежачем положении.
В молодом возрасте возможна в свою очередь первичное непостоянное появление белка в моче, устанавливаемая у здоровых индивидуумов при врачебном исследовании и пропадающая при следующих анализах мочи.
Протеинурия напряжения выявляется у двадцати процентов лиц в здоровом состоянии (даже спортсменов) после сильной физической нагрузки. Белок выявляетсяв начальной подготовленной порции урины. выделение белка с мочой характером связанным с патологией канальцев. Предполагается, что алгоритм появления белка в моче объединен с рекомбинацией тока крови и относительной ишемией проксимальных участков нефрона.
Лихорадочное появление белка в моче встречается при сильных горячих состояниях, в частности у лиц детского возраста и лиц старческого возраста. Лихорадочное выделение белка с мочой имеет преимущественно гломерулярный ход. Процессы этого вида протеинурии мало изучены, изучается возможная важность увеличения клубочковой фильтрации наравне с недолговечным поражением клубочкового фильтра защитными комплексами.
Выделение белка с мочой при патологической избыточной массе тела. Выделение белка с мочой нередко наблюдается при анормальном отложении жира в теле. (вес тела более 115 килограммов). По данным J.P.Domfeld (1989), среди одной тысячи пациентов с патологическим отложением жира в теле. у 420 диагностировано выделение белка с мочой без перерождений отстоя урины; показаны и прецеденты нефротического синдрома. Предполагается, что в первопричине формирования такой протеинурии располагаются искажения кровообращения скопления сильно фенестрированных капилляров (повышение давления в группе капилляров почечного тельца, повышенная скорость фильтрации), связанные с повышением при патологической избыточной массе тела. концентрации полипептидного гормона, вырабатываемого почкой вследствие понижения кровяного давления и гипертензин, которая при голодании убавляется. При снижении веса, а также при лечении замедлителями АПФ выделение белка с мочой может убавляться, а также утрачиваться.
Вдобавок, протеинурия может иметь внепочечное начало. При присутствии лейкоцитов в анализе мочи и особенно появление крови в моче удостоверяющая реакция на полипептид может быть итогом распада форменных элементов крови при длительном стоянии урины, в данной обстановке ненормальным представляется появление белка в моче превышающее, 0,3 грамма/сут. Осадочные полипептидные проверки способны давать ложноположительные результаты при присутствии в urina йодосодержащих контрастных материалов, немалого числа сходных препаратов Penicillinum а также лекарственного вещества из группы полусинтепнческих беталактамовых антибиотиков, продуктов метаболизма сульфаниламидных препаратов.
Похожая информация.